Moku:Lab 锁相放大器在受激拉曼散射显微镜的应用
日期:2020-11-10 浏览量:2940拉曼现象由印度科学家 C.V. 拉曼于1920年代发现 1, 2。如今,拉曼光谱已成为广泛使用的探知分子振动模式的方法 3,4。与其他分析化学方法相比,光谱方法可以提供很高的空间分辨率,探测装置无需与样品相接触。分子振动光谱提供了相对较高的化学特异性,且不需要额外的标记。然而,自发拉曼现象是一个非常弱的散射现象。如果直接使用自发拉曼进行成像或者显微研究,一张图可能需要几小时的采集时间。因此,相干拉曼方法,如受激拉曼散射如今被广泛的应用于显微镜研究。在这个应用指南中,我们将讲述如何使用 Moku:Lab 的锁相放大器进行受激拉曼散射的信号探测。
▍背景介绍
拉曼光谱是一种非破坏性的分析化学方法。它可以用来直接探测分子的振动模式。相比于基于电子能级的光谱光谱方法,拉曼光谱显著提高了测量的特异性,而且不需要在系统中引入荧光标记。被测样品可以以完全无接触,无标记的方法进行检测,防止了其他因素对系统的影响 6,7。红外光谱是另一种常见的分子振动光谱方法。红外与拉曼光谱有着不同的选择定则。红外光谱对偶极子的变化敏感,而拉面光谱则对极化率敏感 4。这使得红外与拉曼对特定的化学键振动有着更好的探测效果。对于成像应用,还有两个其他的考虑因素:1)红外有着较长的波长,通常达到几个微米。这使得成像的空间分辨率被其波长本身所限制。拉曼可以使用可见或近红外光源,所以可以达到更高的高的空间分辨率。2)水分子对红外有着很强的吸收。在水较为丰富的环境中,比如生物样品,红外光谱可能会受到较强背景吸收的影响。因此,拉曼光谱在这些情况下通常有着更广泛的应用。
拉曼散射相对于瑞利散射,是一个较弱的散射现象。通常,一个光谱测量需要进行几秒钟的信号平均以获得足够的信噪比。对于光谱测量,这本身不是一个问题。然而,对于光谱成像而言,这意味着一张图可能需要几个小时的信号平均,严重限制了高通量样品检测的能力。因此,多种不同的方法相继被用来提高拉曼信号的强度。比如使表面则强拉曼可以使得拉曼光谱的探测极限到达单分子层级 8。然而,这些测量所引入的纳米颗粒很难均匀的分布到样品中,因此难以做到定量分析。对于成像科学来说,非线性光学效应产生的增强效果是一个更加适合的方法。比如受激拉曼散射(SRS)效应,以及相干反斯托克拉曼散射(CARS)效应。

相干拉曼效应最早于 1960 年代被发现 6。在 90 年代晚期和 00 年代,随着超快锁模激光的发展,谢晓亮以及其同事相继发表了有关 CARS9 和 SRS10 的无标记化学信息显微镜论文。此后,这些技术被广泛应用到有关化学,生物学以及材料学的研究当中 6,7,11。CARS 和 SRS 有着诸多相似性:这些非线性光学过程通常会发生在同样的条件下,且实验所需的仪器设置大致相同。当然,也有一些不同点:比如 CARS 的信号(图 1,ωas)与自发拉曼相似,发生在与输入光源(ωp, pump, ωs Stokes)不同的波长。因此,通过短通滤波片可以轻易将信号分离。信号本身光强较弱,所以一般使用比较敏感的探测器,比如光电倍增管(PMT)进行探测。然而,CARS的探测同时会受到一些其他非共振非线性光学现象产生的背景。这些背景限制了实际使用这种 CARS 的检测极限,并同时使所测得的光谱与自发拉曼相比产生一定畸变。另一方面,SRS 信号不受到大多数其他非线性光学现象的影响。然而,SRS 的信号本身发生在与输入光源相同的波长。SRS 现象本身只相应的稍微减弱或增加泵光或者斯托克斯光源。这些相应较小的变化很难用常规方法进行探测,因此,需要使用泵浦-探测以及锁相法进行探测。
▍光学泵浦-探测以及锁相探测
泵浦-探测是多光子探测中常用的方法。这些试验通常使用两束超快激光。一束激光时刻对样品进行照射,另一束激光则通过调幅调制在一个固定的频率。因此,如何由第二束光作用与第一束光所产生的变化都会被传递到第一束光中。在检测段,将调制的光束使用空间,或者滤波片的方法阻挡。只有本身未调制的光能到达探测器。因为信号本身只发生在调制频率,因此,只要使用锁相放大器对调制频率进行检测,就能检测出两束光互相作用所产生的信号。锁相放大器使用混频原理,可将输入的电子信号与本地振荡信号混频,并通过低通滤波器滤除并放大。在频谱中,只有十分接近本地振荡器频率的信号才能被放大并检测。而其他频率的光,比如激光本身的重复频率,以及 DC 背景都会被滤掉。这使得锁相放大器成为泵浦-探测不可或缺的引起。
对于 SRS 的检测,我们将两束激光的能量差精确的调节到我们想要检测拉曼位移的能量级。然后,我们可以对泵浦光,或者斯托克斯光进行调制。如果泵浦光被调制,则 SRS 会对斯托克斯光在调制频率产生一个微弱的增强。如果我们在检测端检测斯托克斯光,则所测得的增强被称作受激拉曼增强(SRG)。相反,如果我们对斯托克斯光进行调制,则 SRS 会对泵浦光在调制频率产生一个微弱的减弱。如果我们在检测端对泵浦进行检测,则所测得的增强被称为受激拉曼减弱(SRL)。在这个应用指南中,我们见使用一个 SRL 检测方法。因为我们所使用的检测器在泵浦光有着更好的检测效率。

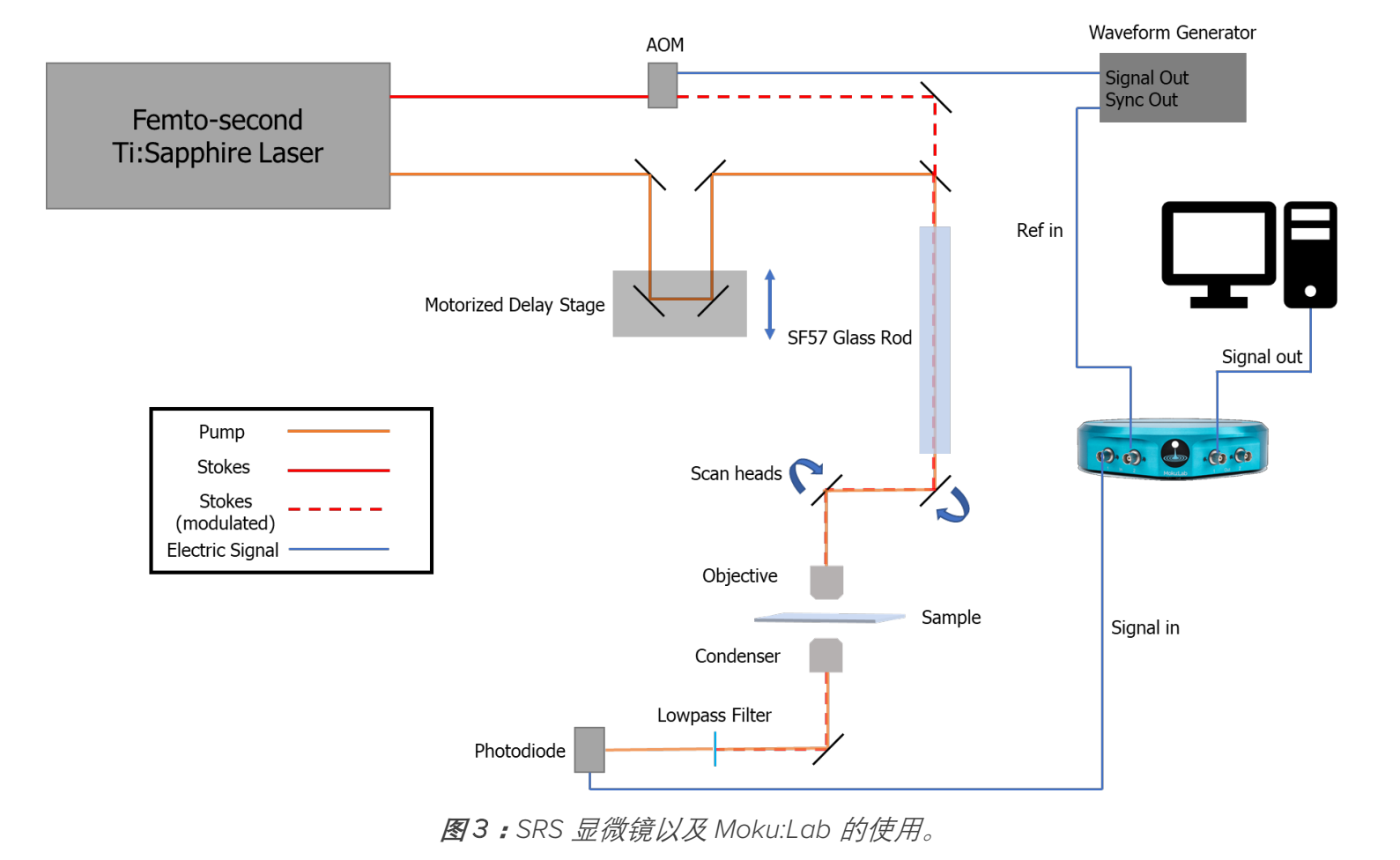
▍试验设置
激光
SRS的产生需要两束超快激光同时在时间和空间上相互交叠。为了获得稳定的时间同步,大部分 SRS 显微镜通常使用一个 Ti:Sapphire 激光产生泵浦和斯托克斯光源。皮秒与飞秒激光都可以用来进行 SRS 的产生。皮秒激光本身拥有更精细的光谱。使用皮秒激光可以利用简单的光学设置达到更高分辨率的光谱。与自发拉曼不同,SRS 一次检测只能测得单色的光谱信息。因此,检测更多的拉曼位移需要调节激光本身的波长。这个过程通常限制了光谱的扫描速度。另一方面,飞秒激光可以使用光谱对焦的方法快速的调节泵浦光与斯托克斯之间的能量差,光谱图像可以在更快的被采集。然而,这个方法显著提高了光路的复杂度。高折射率的材料,比如 SF57玻璃柱,或者一对光栅需要被加入到光路中。同时,光谱扫描的范围本身也有限。一个关于光谱对焦的详细介绍可以在一篇最近发表的文献中查询。
总结来说,如果成像只需要测量单个拉曼位移,则皮秒激光可以简化光路的设置。对于光谱图象的采集,飞秒激光可以极大的提高采集速度。Moku:Lab 的锁相放大器可以与皮秒或者飞秒激光所配合使用。在这个应用指南中,我们将使用飞秒激光(Spectra-physics Mai Tai)配合 SF57 玻璃柱对光谱对焦SRS进行演示。
调制,延时台,以及扫描镜
泵浦光和斯托克斯光通常会使用电光调制器(EOM)或声光调制器(AOM)进行调制。调制频率通常在兆赫兹的频段。这样可以有效的降低光热效应,提高图像采集的速度。在这个应用指南中,我们将使用 AOM 对泵浦光在 2 兆赫的频率进行调制。
在光路中,一个电动延时台被用来准确的调节泵浦和斯托克斯光之间的延时。对于光谱对焦的 SRS 来说,这个延时台同时被用来微调两束光之间的能量差。
像大多数非线性光学成像系统一样,SRS 和 CARS 的成像大多使用的是光束扫描的方法。一堆振镜被放置在物镜前对光线进行扫描。在这个展示中,我们使用了一对 Thorlabs 的 GVS 102 振镜。
物镜,聚光镜,探测器,数据采集
当激光经过振镜扫描后,通过物镜在样品上形成一个焦点。相干拉曼成像通常使用高 NA 的水镜或者油镜进行测量,从而更有效地达到相位匹配的条件。通过样品后,光在前进方向被采集,并重新聚焦在探测器上。通常,我们使用浸油聚光镜来提高采集效率。在这个示例中,我们使用了 1.2NA,60 倍(UPLSASP 60XW, 奥林巴斯)的物镜对光进行了聚焦。
光被聚光镜采集后,通过了一个光学滤镜阻断被调至的光后,被重新聚焦到了光电二极管上。二极管所产生的信号随后被送入锁相放大器。取决于光电二极管的结构,电流或电压前置放大器可以被放置于二极管和锁相放大器之间。锁相放大器随后将收集的信号与本地振荡器混频,将调制的 AC 信号转换成 DC 信号,放大并输出。信号随后被送入采集卡中成图并储存。在这个应用指南中,一个 Hamamatsu S3994-01 光电二极管,配合一个自制的电流电压转换器被用来检测光学滤镜后所剩余的信号。这个信号被 Moku:Lab 的锁相放大器以外部参考(PLL)模式,7 微秒二阶的时间常数进行解调。解调后,这个信号被加以一个 10 dB 的增益,最后送到了 NIDAQ 系统对信号,配合 NI 的虚拟仪器进行最后的处理合成图。
▍结果与讨论
我们使用 SRS 显微镜对一个二甲基亚砜(DMSO)的液滴进行了检测。我们挑选了液滴的边缘作为成像区域。激光与振镜前被调节成了 798 nm 的泵光(30 mW)以及 1040 nm 的斯托克斯光(150 mW)。通过改变延时台,我们在可调光谱范围内采集了 100 张图像。在图 4 中,我们展示了这个液滴边缘的 x-y(左侧)以及 z(右侧)方向的信息。在光谱中,我们可以观察到 C-H 键在此区间产生的两个共振峰。
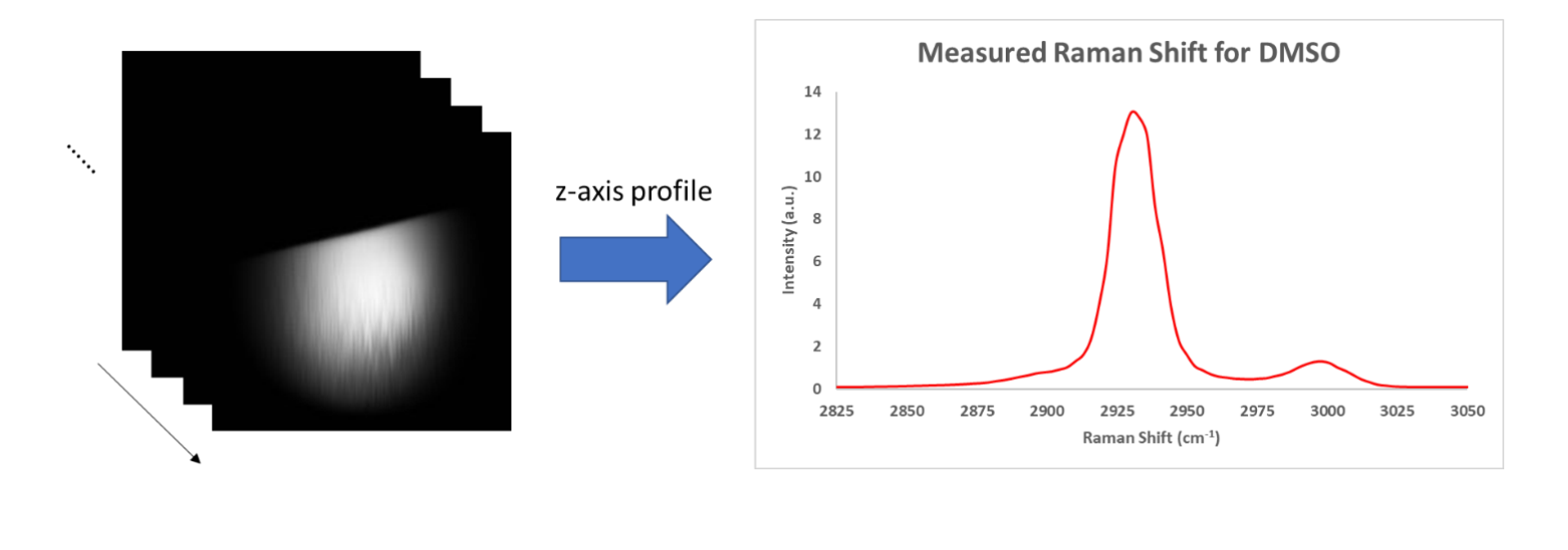
图 4:二甲基亚砜液滴的 SRS 图像。
我们通过使用最亮的图像切层(约在 2930 cm-1)来计算图片的信噪比。我们选取了信号区域与背景区域,10X10 的区域,并使用信号去的平均值除以背景区的标准差定义为信噪比,最终算出了大约为 1100 的信噪比。
参考文献
1. Raman, C. V. (1922). The molecular scattering of light. University of Calcutta.
2. Raman, C. V. (1928). A new radiation.
3. Long, D. A. (1977). Raman spectroscopy. New York, 1-12.
4. Colthup, N. (2012). Introduction to infrared and Raman spectroscopy. Elsevier.
5. Zhang, S., Song, Z., Godaliyadda, G. D. P., Ye, D. H., Chowdhury, A. U., Sengupta, A., ... & Simpson, G. J. (2018).Dynamic sparse sampling for confocal Raman microscopy. Analytical chemistry, 90(7), 4461-4469.
6. Prince, R. C., Frontiera, R. R., & Potma, E. O. (2017). Stimulated Raman scattering: from bulk to nano. Chemical reviews, 117(7), 5070-5094.
7. Zhang, C., & Cheng, J. X. (2018). Perspective: Coherent Raman scattering microscopy, the future is bright. APL Photonics, 3(9), 090901.
8. Nie, S., & Emory, S. R. (1997). Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science, 275(5303), 1102-1106.
9. Zumbusch, A., Holtom, G. R., & Xie, X. S. (1999). Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical review letters, 82(20), 4142.
10. Freudiger, C. W., Min, W., Saar, B. G., Lu, S., Holtom, G. R., He, C., ... & Xie, X. S. (2008). Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science, 322(5909), 1857-1861.
11. Cheng, J. X., & Xie, X. S. (Eds.). (2016). Coherent Raman scattering microscopy. CRC press.
12. Liao, C. S., Huang, K. C., Hong, W., Chen, A. J., Karanja, C., Wang, P., ... & Cheng, J. X. (2016). Stimulated Raman spectroscopic imaging by microsecond delay-line tuning. Optica, 3(12), 1377-1380.
 用于相干拉曼显微成像和受激拉曼显微成像的低噪声快速调谐光源
用于相干拉曼显微成像和受激拉曼显微成像的低噪声快速调谐光源  Moku:Lab锁相放大器在微弱信号检测应用及技术参数
Moku:Lab锁相放大器在微弱信号检测应用及技术参数  Moku:Lab电源稳定性分析-频率响应分析仪应用指南
Moku:Lab电源稳定性分析-频率响应分析仪应用指南  Moku:Lab客户案例-山东大学海洋研究院高性能激光稳频方案
Moku:Lab客户案例-山东大学海洋研究院高性能激光稳频方案  Moku:Lab应用于激光器长时间稳频
Moku:Lab应用于激光器长时间稳频